精彩内容
近年来,随着仿制药一致性评价、国家及地方带量采购、药品审评审批等政策落地实施,研发创新成为医药行业发展主旋律,而研发投入及研发管线构建成为衡量一家企业是否具有自主创新能力的主要标准。2019年A股有两家药企研发投入超过30亿元,分别为恒瑞医药、复星医药,那么这两家药企都有哪些新药获批上市?在研新药中哪些有望成为重磅品种?
“医药股一哥”5年累计研发投入超百亿,6个创新药已上市
图1:2015-2019年恒瑞医药研发投入情况(单位:亿元)
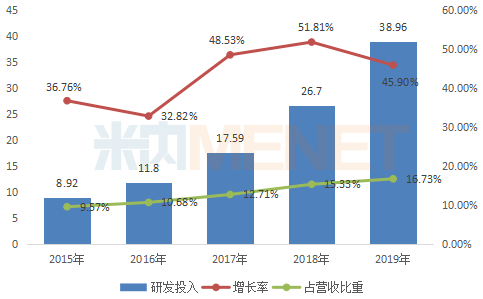
恒瑞医药年报数据显示,近5年来,公司逐年加大研发力度,研发投入年增长率保持在2位数。2016年为分水岭,研发投入首次突破10亿元,研发投入占营收比重突破超过10%,此后一直保持在10%以上。
历经多年发展,恒瑞医药创新药模式从创新初期的“me-too”、“me-better”逐步走向源头创新;在创新药布局上,实现从小分子药物向大分子药物转变;在创新药开发上,基本形成每年都有创新药申请临床,每1-2年都有创新药上市的良性发展态势。
表1:近10年恒瑞医药获批上市的新药
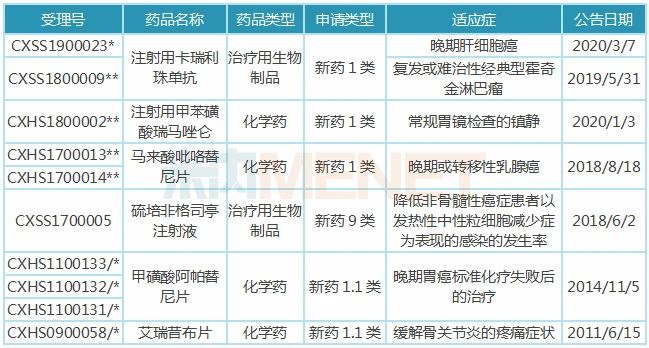
注:带*为优先审评品种,**为特殊审评+优先审评品种,/*为重大专项+特殊审评品种
近10年来,恒瑞医药有6个创新药获批上市,分别为艾瑞昔布、阿帕替尼、硫培非格司亭、吡咯替尼、卡瑞利珠单抗和甲苯磺酸瑞马唑仑。除了硫培非格司亭,其余5个均为国产1类新药。
艾瑞昔布是恒瑞医药首个获批上市的1类新药,是公司在研发创新上的破局及最具代表性的成果,公司于2011年获得该产品生产批件,2017年才进入国家医保实现放量,米内网数据显示,2018年中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端及城市零售药店终端艾瑞昔布销售额为3.83亿元。
阿帕替尼于2014年11月获批上市,2015年国内市场(中国公立医疗机构终端及城市零售药店终端)销售额即接近6亿元,2017年该产品通过谈判降价进入国家医保,2018年国内市场销售额为25.11亿元,名副其实的重磅炸弹。2019年阿帕替尼续谈成功,进一步提高用药可及性,硫培非格司亭、吡咯替尼新纳入国家医保目录,有望借助医保迅速放量。
注射用卡瑞利珠单抗是第3个获批上市的国产PD-1,也是首个获批用于晚期肝细胞癌的PD-1,目前已有2个适应症获批上市,“大病种”和“联用”有望助推卡瑞丽珠单抗成为明星品种。
表2:恒瑞医药部分在研新药
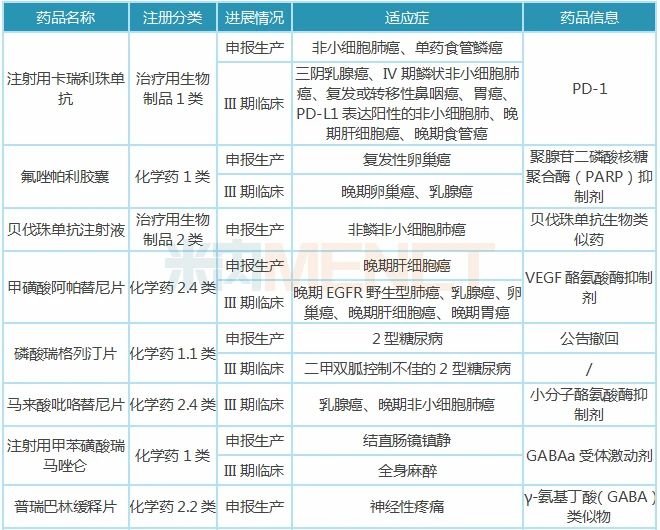
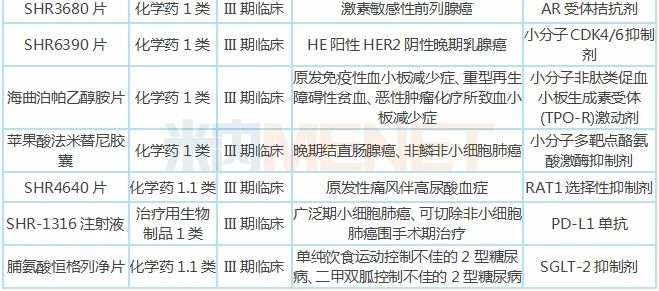
注:只列举临床进展较快(III期及以上)的在研新药,含联用,不含疫苗、原料药、中成药
米内网数据显示,近10年来,恒瑞医药获得CDE承办受理的新药(含1类、2类,不含原料药,下同)上市申请受理号有21个(涉及9个品种),其中9个受理号(5个品种)批准生产;获得CDE承办受理的新药临床申请受理号有210个(涉及69个品种)。
卡瑞利珠单抗晚期肝细胞癌、复发或难治性经典型霍奇金淋巴瘤两大适应症获批,非小细胞肺癌、单药食管鳞癌适应症报产,三阴乳腺癌、IV期鳞状非小细胞肺癌、复发或转移性鼻咽癌等适应症进行到III期临床;阿帕替尼晚期胃癌适应症获批,晚期肝细胞癌报产,乳腺癌、卵巢癌等适应症进行到III期临床。卡瑞利珠单抗与阿帕替尼在机制和疗效上具有良好的协同作用,目前恒瑞已开展多项两者的联用试验。
吡咯替尼晚期或转移性乳腺癌适应症获批,乳腺癌、晚期非小细胞肺癌适应症进行到III期临床;甲苯磺酸瑞马唑仑胃镜诊疗镇静适应症获批,结直肠镜镇静适应症报产,全身麻醉适应症进行到III期临床。
氟唑帕利复发性卵巢癌适应症报产,晚期卵巢癌、乳腺癌等适应症进行到III期临床;贝伐珠单抗生物类似药报产,用于治疗非鳞非小细胞肺癌;SHR3680片、SHR6390片、海曲泊帕乙醇胺片、苹果酸法米替尼胶囊、SHR4640片、SHR-1316注射液、脯氨酸恒格列净片等1类新药研发进展最快已到III期临床,之后将陆续提交上市申请。
除了自主研发,恒瑞医药也引进国外先进创新药品及技术,包括美国Mycovia公司抗真菌感染的专利先导化合物VT-1161,德国Novaliq公司治疗干眼症的药物CyclASol和NOV03等,不断丰富公司的研发管线。
生物药领头羊,拿下国内首个生物类似物,产品升级迭代进行中
图2:2015-2019年复星医药研发投入情况(单位:亿元)
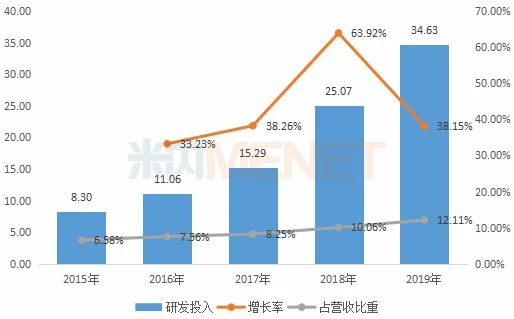
近5年来复星医药逐年加大研发力度,累计研发投入94.35亿元,其中在制药业务合计81.57亿元。2019年集团研发投入共计34.63亿元,同比增长38.15%,其中在制药业务上的研发投入为31.31亿元,同比增长39.12%,占制药业务营收比重为14.38%。
复星医药持续完善“仿创结合”的药品研发体系,建设“4+3”研发平台(四大平台:小分子创新药、高价值仿制药、生物药、细胞治疗;三大体系:许可引进、深度孵化、风险投资),尤其加大小分子创新药、单克隆抗体生物创新药及生物类似药、CAR-T细胞药物等在内的研发力度。
表3:近10年复星医药获批上市/进口的新药
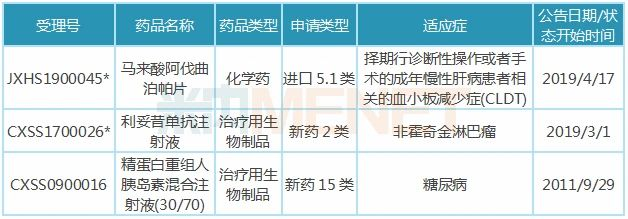
注:带*为优先审评品种
2019年3月,国内首个生物类似药(利妥昔单抗注射液)获批上市,花落复星医药控股子公司复宏汉霖,商品名汉利康,用于治疗非霍奇金性淋巴瘤;同年5月中旬,汉利康正式商业化并快速得到市场认可,2019年全年销售额约1.5亿元。
2020年4月15日,复星医药发布公告称,汉利康近日获批增加原液2000L生产规模及2000L生产设备,突破了获批上市初期500L生产设备导致的产能瓶颈,预计2020年汉利康有望快速上量。
复星医药引进的许可产品马来酸阿伐曲泊帕片是第二代、每日一次的口服首个血小板生成素(TPO)受体激动剂,其择期行诊断性操作或者手术的成年慢性肝病患者相关的血小板减少症(CLDT)适应症已于近期获批进口。目前全球已上市的阿伐曲泊帕片仅为AkaRx的Doptelet®,于中国境内尚无具有自主知识产权、且与该新药同类产品上市。
表4:复星医药部分在研新药
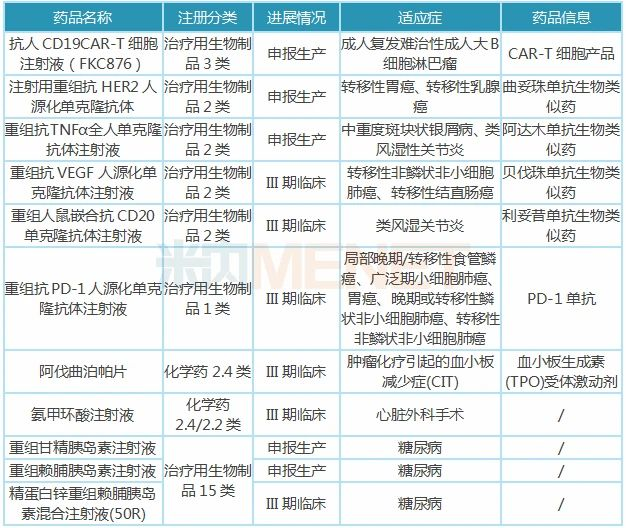
注:只列举临床进展较快(III期及以上)的在研新药,含联用,不含疫苗、原料药、中成药
截至2019年,复星医药已有9个小分子创新药产品(含1个改良型新药)、9个适应症于中国境内获临床试验批准;3个小分子创新药、3个适应症获境外临床试验许可。公司小分子创新药多处于I期临床试验。引进的阿伐曲泊帕片CLDT适应症已获批,CIT适应症处于III期临床。
首个国产CAR-T细胞产品有望于2020年底前获批上市。抗人CD19CAR-T细胞注射液(FKC876)上市申请(成人复发难治性大B细胞淋巴瘤)于2020年2月26日获得CDE承办受理,并于同年3月纳入优先审评;此外,公司引进ReNeuron针对脑卒中后残疾及视网膜色素变性的细胞治疗产品,打造干细胞平台。
2大生物类似药有望在2020年获批上市,12个单抗和8个联合治疗方案在全球范围内开展超过20项临床试验。曲妥珠单抗转移性胃癌、转移性乳腺癌适应症报产,阿达木单抗类风湿性关节炎、中重度斑块状银屑病适应症报产;贝伐珠单抗转移性非鳞状非小细胞肺癌、转移性结直肠癌适应症处于III期临床。
PD-1单抗(HLX10)多个联合疗法进入III期临床,包括联合化疗(顺铂+5-FU)一线治疗局部晚期/转移性食管鳞癌、联合化疗(卡铂-白蛋白紫杉醇)一线治疗局部晚期或转移性鳞状非小细胞肺癌等,未来有望与生物类似药、小分子创新药形成有力联合竞争优势。
从长期看,复星医药产品升级迭代正在发生,第一阶段非布司他片、匹伐他汀等产品正迭代过去的小牛血清去蛋白等产品;单抗、小分子靶向药等即将成为第二阶段主力;细胞治疗药物、干细胞药物、firstinclass创新药等成为第三阶段支持。第一阶段、第二阶段产品升级同时进行中,未来公司利润结构转换也在进行中。
来源:米内网数据库、上市公司公告
注:数据统计截至4月17日,如有疏漏,欢迎指正!